دما و غلظت محلول در سیکل چیلر جذبی
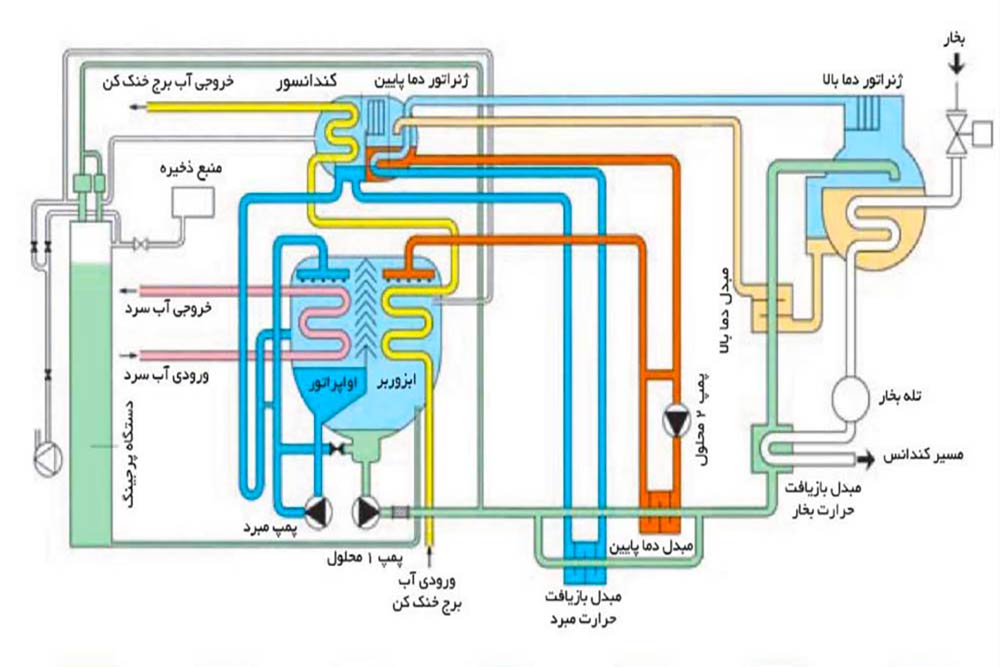
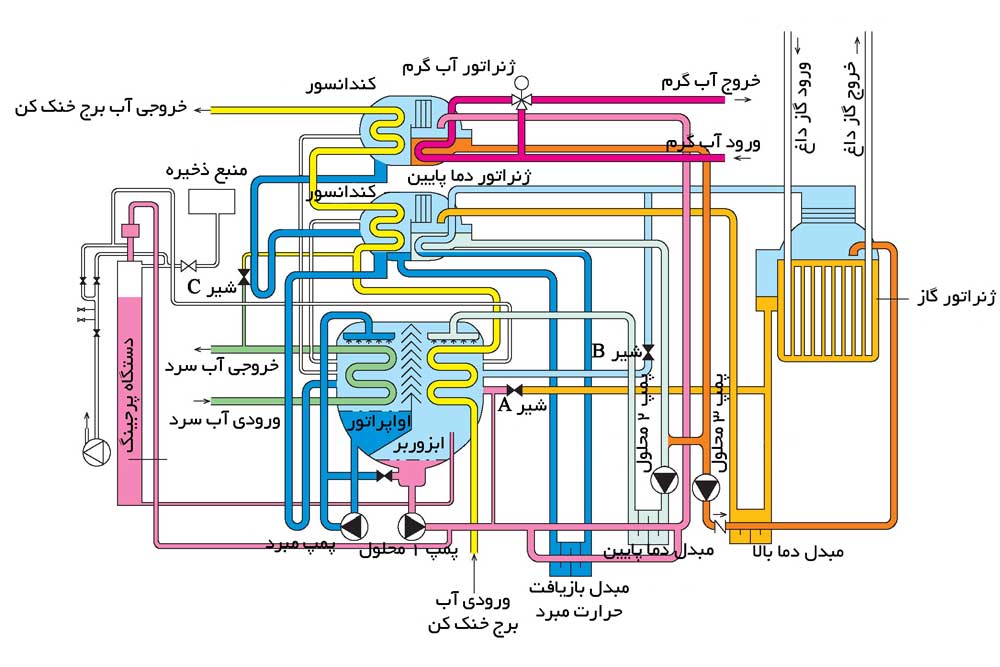
هدف از تحلیل سیکل چیلر جذبی، محاسبه دما و غلظت محلول در نقاط مختلف چیلر جذبی است تا درک بهتری از کارکرد صحیح دستگاه و چالش های کریستال شدن داشته باشیم . همانطور که میدانیم اواپراتور، ابزوربر، کندانسور، ژنراتور و محلول جاذب، اساسی ترین قسمت های چیلر جذبی هستند. در شکل ۱، شماتیک سیکل یک چیلر جذبی با محلول جاذب لیتیوم بروماید (LiBr) نشان داده شده است. در ابزوربر، بخار مبرد (آب) توسط محلول جاذب (لیتیوم بروماید) جذب می شود و محلول رقیق ایجاد شده، توسط پمپ به ژنراتور منتقل می گردد. در اثر حرارت دهی به محلول رقیق در ژنراتور، مبرد به صورت بخار از محلول جدا شده و به کندانسور، اواپراتور و درنهایت ابزوربر منتقل می شود(نقاط ۷ تا ۱۰ در شکل ۱) . محلول غلیظ نیز جهت ادامه این چرخه به ابزوربر انتقال داده می شود( نقاط ۴ تا ۶). محلول غلیظ در مسیر بازگشت، از مبدل حرارتی بازیافت انرژی عبور داده می شود تا در اثر انتقال حرارت، باعث پیش گرم شدن محلول رقیق ورودی به ژنراتور و کاهش مصرف انرژی در ژنراتور گردد.
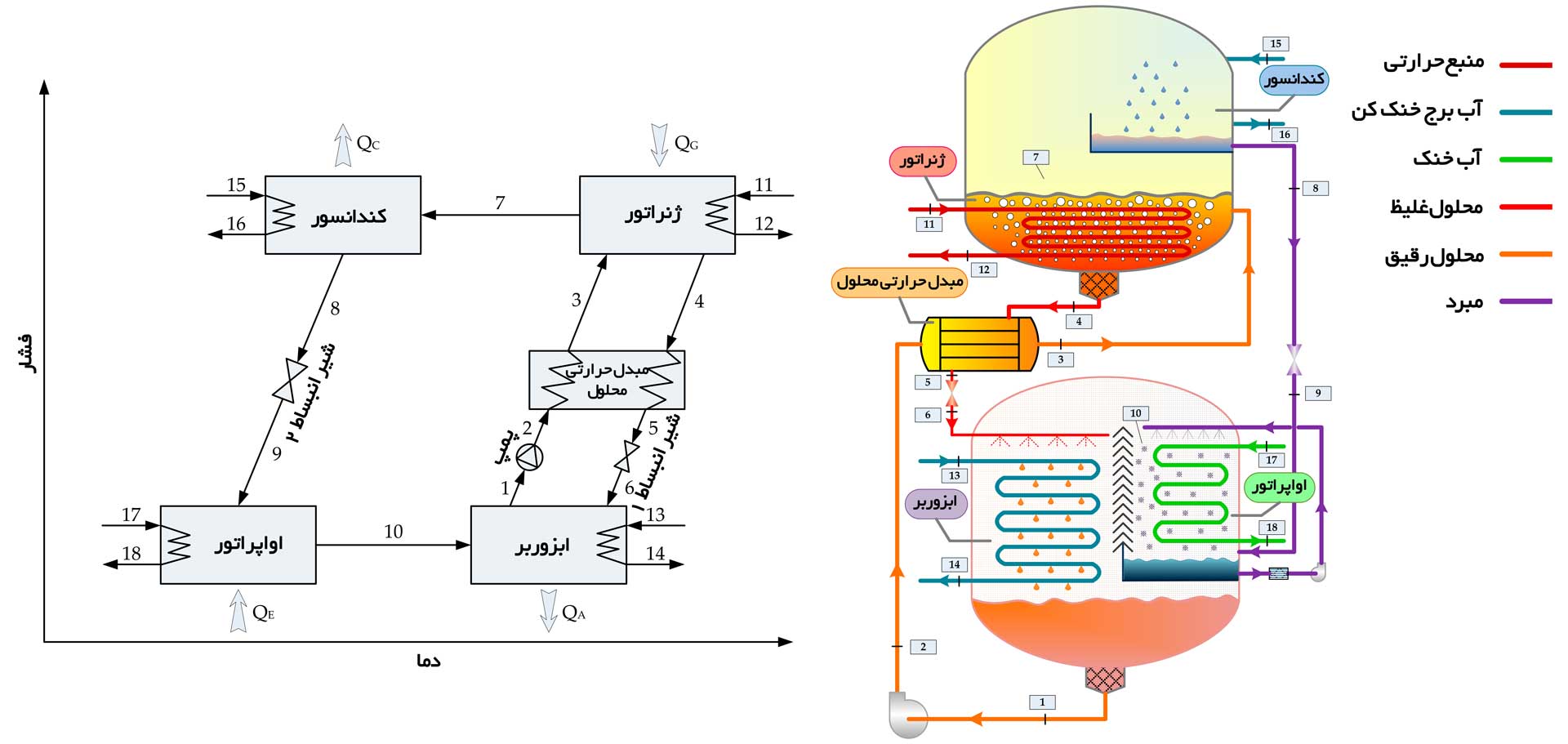
شکل – ۱، شماتیک سیکل چیلر جذبی
نقطه جوش آب با فشار رابطه مستقیم دارد. همچنین اضافه شدن نمک به آب، باعث افزایش نقطه جوش آب می گردد. از این دو پدیده فیزیکی کاملا شناخته شده، در چیلر های جذبی استفاده شده است. مبرد (آب) که به صورت بخار از اواپراتور به ابزوربر وارد می شود، توسط لیتیوم بروماید جذب شده و نقطه جوش مبرد نیز افزایش می یابد. نقطه جوش آب با غلظت محلول رابطه مستقیم دارد، هرچقدر که غلظت محلول بیشتر باشد، دمای جوش آب نیز بیشتر خواهد بود اما در چیلر های جذبی به دلیل پدیده کریستال شدن، غلظت محلول در دمای ثابت بیش از مقدار معینی افزایش داده نمی شود. به طور کلی، افزایش نقطه جوش بین محلول و مبرد خالص تابعی از دما و غلظت است با این حال ارزیابی داده های تجربی به دست آمده نشان می دهد که در دمای ثابت محلول، افزایش نقطه جوش نسبت به غلظت محلول، رابطه خطی دارد. به بیان دیگر با داشتن دمای اشباع مبرد (یا فشار)، نقطه جوش محلول در غلظت های مختلف قابل محاسبه است. به این پدیده، قانون دورینگ (Duhring’s rule) می گویند که رابطه آن به صورت زیر بیان می شود:
رابطه – ۱
TSAT,SOL = AD.TSAT,REFR + BD
در رابطه ۱، AD و BD ثابت های دورینگ هستند که مقدار هر دو تابعی از غلظت محلول است. همچنین TSAT,SOL و TSAT,REFR به ترتیب دمای اشباع محلول و مبرد است. نمودار دورینگ برای محلول لیتیوم بروماید – آب در شکل ۲ نشان داده شده است. با داشتن فشار اشباع بخار مبرد، نقطه جوش محلول در غلظت های مختلف قابل محاسبه است. محور سمت چپ این نمودار بر اساس نقطه شبنم مبرد در فشار های مختلف تقسیم بندی شده است. بنابراین، در این شکل با داشتن نقطه شبنم مبرد نیز، نقطه جوش محلول در غلظت های مختلف قابل محاسبه است. همچنین منحنی قرمز رنگ بیانگر محدوده کریستال شدن است. به عنوان مثال در فشار اشباع ۲۰ mbar و غظت محلول ۷۰%، محلول لیتیوم بروماید-آب در ناحیه کریستال شدن قرار دارد. جهت خروج از این ناحیه در غلظت ثابت باید فشار اشباع بخار مبرد افزایش یابد. همچنین با داشتن دمای اشباع محلول، غلظت محلول در فشار های مختلف قابل محاسبه است. در شکل ۳ که نمایش دیگری از نمودار دورینگ است، این موضوع نشان داده شده است.
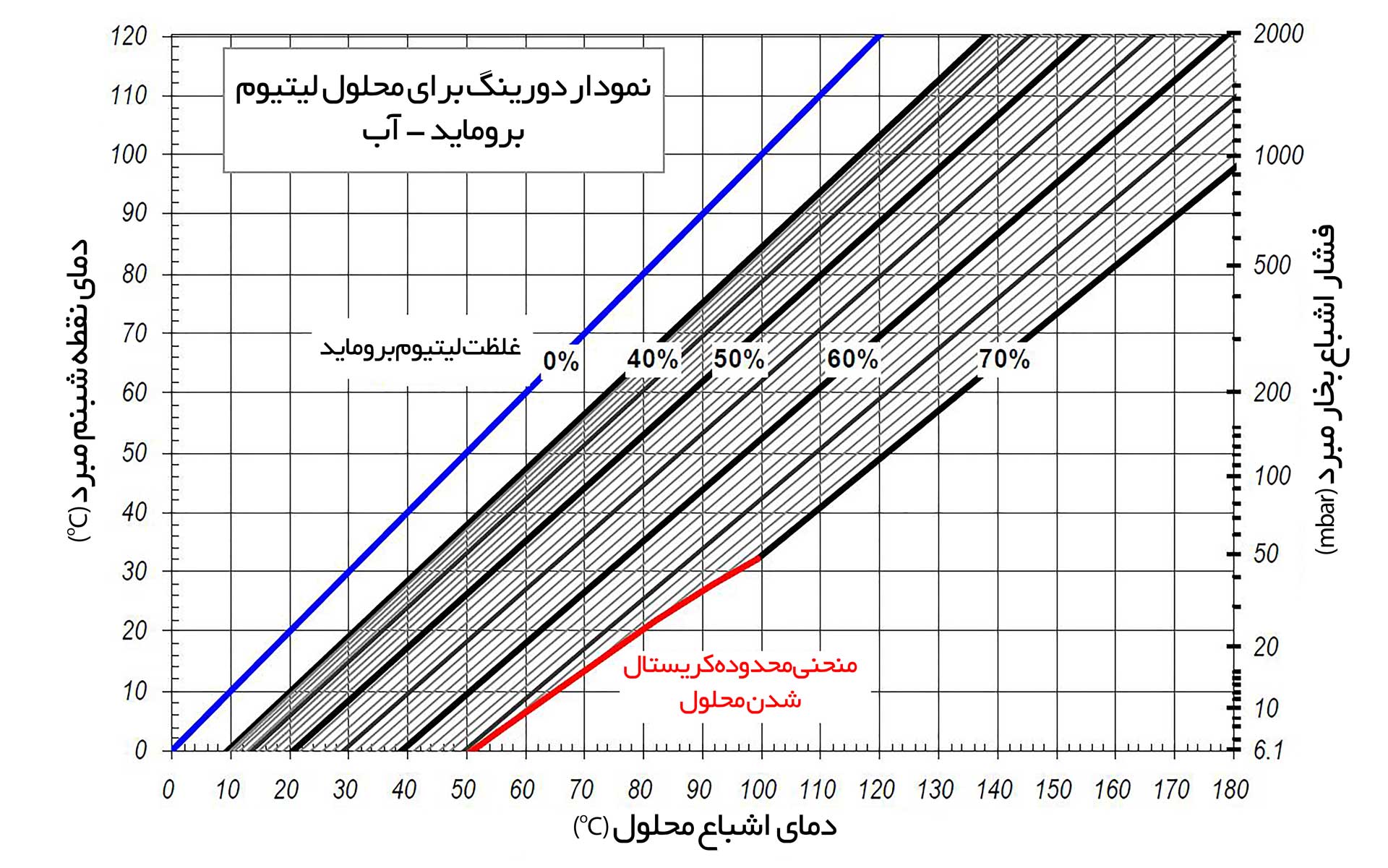
شکل – ۲، نمودار دورینگ برای محلول لیتیوم بروماید – آب
همانطور که در بالا گفته شد است، با جدا شدن مبرد از محلول، محلول غلیظ ایجاد می شود. این رابطه به صورت زیر بیان می شود:
رابطه – ۲ ṁstrong = ṁweak – ṁrefr
نسبت دبی مخصوص برای محلول به صورت نسبت دبی محلول به دبی مبرد تعریف می شود. رابطه ۳ بیانگر این تعریف است.
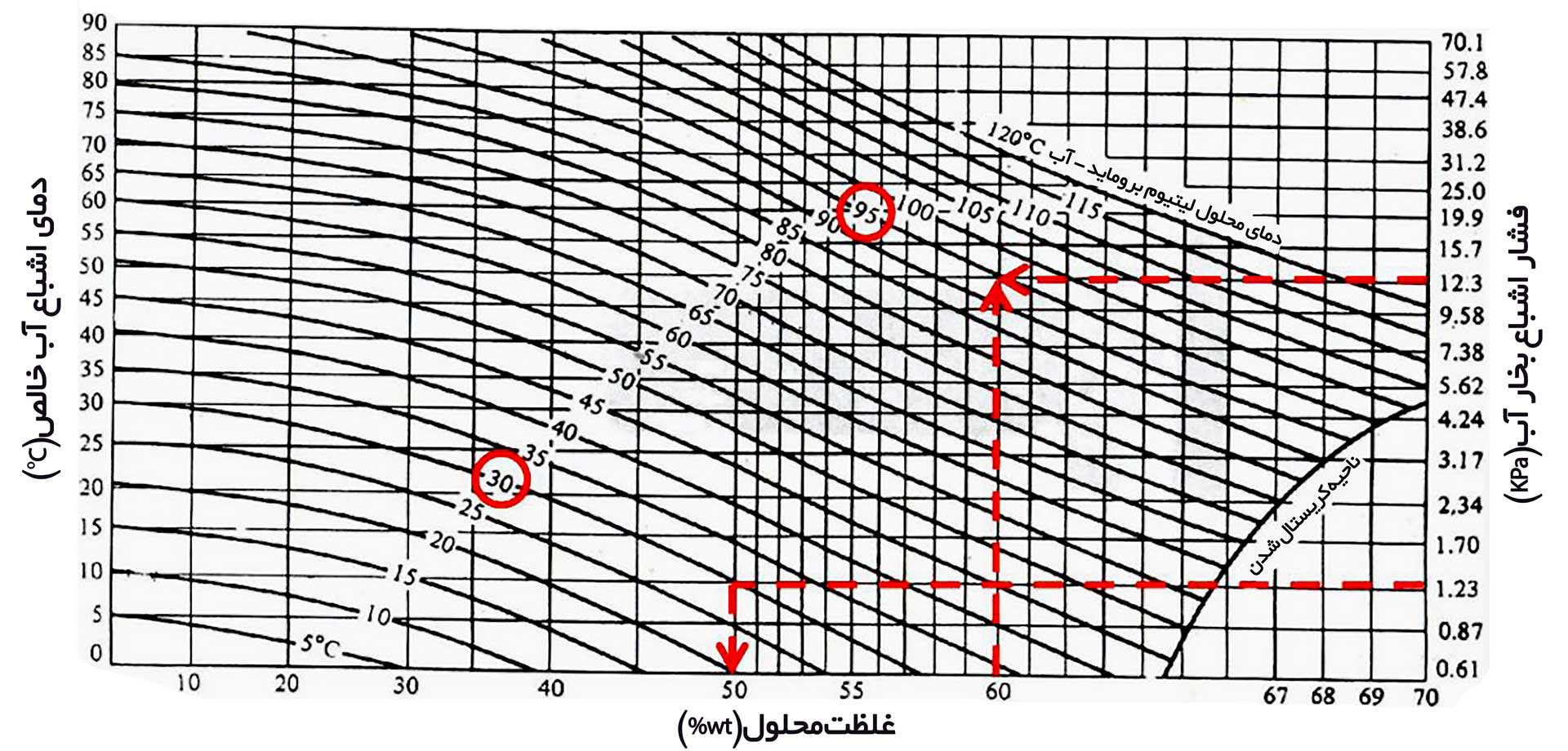
شکل – ۳، نمودار دورینگ برای محلول لیتیوم بروماید – آب
رابطه – ۳
fstrong = ṁstrong/ṁrefr
fweak = ṁweak/ṁrefr
با استفاده از تعریف غلظت، رابطه ۳ به صورت زیر نوشته می شود:
رابطه – ۴
fstrong = Xweak/ΔXsol
fweak = Xstrong/ΔXsol
در رابطه ۴، X بیانگر غلظت محلول است. از رابطه ۴ میتوان نتیجه گرفت با داشتن نسبت دبی محلول و معلوم بودن غلظت محلول رقیق، غلظت محلول غلیظ قابل محاسبه است.
با فرض ثابت بودن تاثیر دما بر تغییرات غلظت محلول، برای دمای اواپراتور و کندانسور رابطه زیر برقرار است.
رابطه – ۵
TE = (TA – BD)/AD
TC = (TG – BD)/AD
در جدول ۱، تفاوت بین چیلر های جذبی تک اثره و دو اثره نشان داده شده است. در جدول ۲، استاندارد عملکرد چیلر های جذبی بر اساس استاندارد ANSI/ARI و استاندارد آلمان نشان داده شده است. همچنین در جدول ۳، اختلاف دما در چیلر جذبی بر اساس کمترین اختلاف دمای مجاز، اختلاف دمای مجاز برای استفاده از انرژی با کیفیت پایین و بالا به عنوان منبع حرارتی در ژنراتور نشان داده شده است. با استفاده از رابطه ۵ و استاندارد جدول ۲، دمای نقاط مختلف محاسبه شده و با استفاده از قانون دورینگ، شکل ۴ حاصل می گردد.
جدول – ۱، تفاوت عملکرد چیلر جذبی تک اثره و دو اثره
|
اطلاعات عملکرد |
تک اثره | دو اثره |
| آب خنک خروجی (oC) | ۵ … ۸ | ۵ … ۸ |
| ورود آب برج خنک کن (oC) | ۲۶ … ۳۲ | ۲۶ … ۳۲ |
| دمای ژنراتور (oC) | ۸۰ … ۱۴۰ | ۱۵۰ … ۱۹۰ |
| ضریب عملکرد | ۰٫۶ … ۰٫۸ | ۱٫۱ … ۱٫۵ |
جدول – ۲، استاندارد دمایی چیلر های جذبی
| استاندارد | تک اثره ANSI/ARI | دو اثره ANSI/ARI | استاندارد جذبی آلمان |
| ورود آب خنک (اواپراتور) | ۱۲٫۲ oC | ۱۲٫۲ oC | ۱۲ oC |
| خروج آب خنک (اواپراتور) | ۶٫۷ oC | ۶٫۷ oC | ۶ oC |
| ورود آب برج (ابزوربر) | ۲۹٫۴ oC | ۲۹٫۴ oC | ۲۷ oC |
| خروج آب برج (کندانسور) | ۳۸٫۴ oC | ۳۵٫۵ oC | ۳۵ oC |
جدول – ۳، اختلاف دما در اجزای چیلر جذبی
| اختلاف دما | کمترین | انرژی بی کیفیت | انرژی با کیفیت |
| کندانسور | ۱K> | ۲-۵K | ۴-۷K |
| اواپراتور | ۱K> | ۳-۵K | ۵-۷K |
| ابزوربر | ۱-۲K | ۵-۱۰K | ۱۰-۱۵K |
| ژنراتور | ۱-۲K | ۵-۱۰K | ۱۰-۲۰K |
| ژنراتور* | ۱۰-۱۵K | ۵-۱۰K | ۱۰-۲۰K |
* دسته لوله ها کاملا در محلول مستغرق شده اند
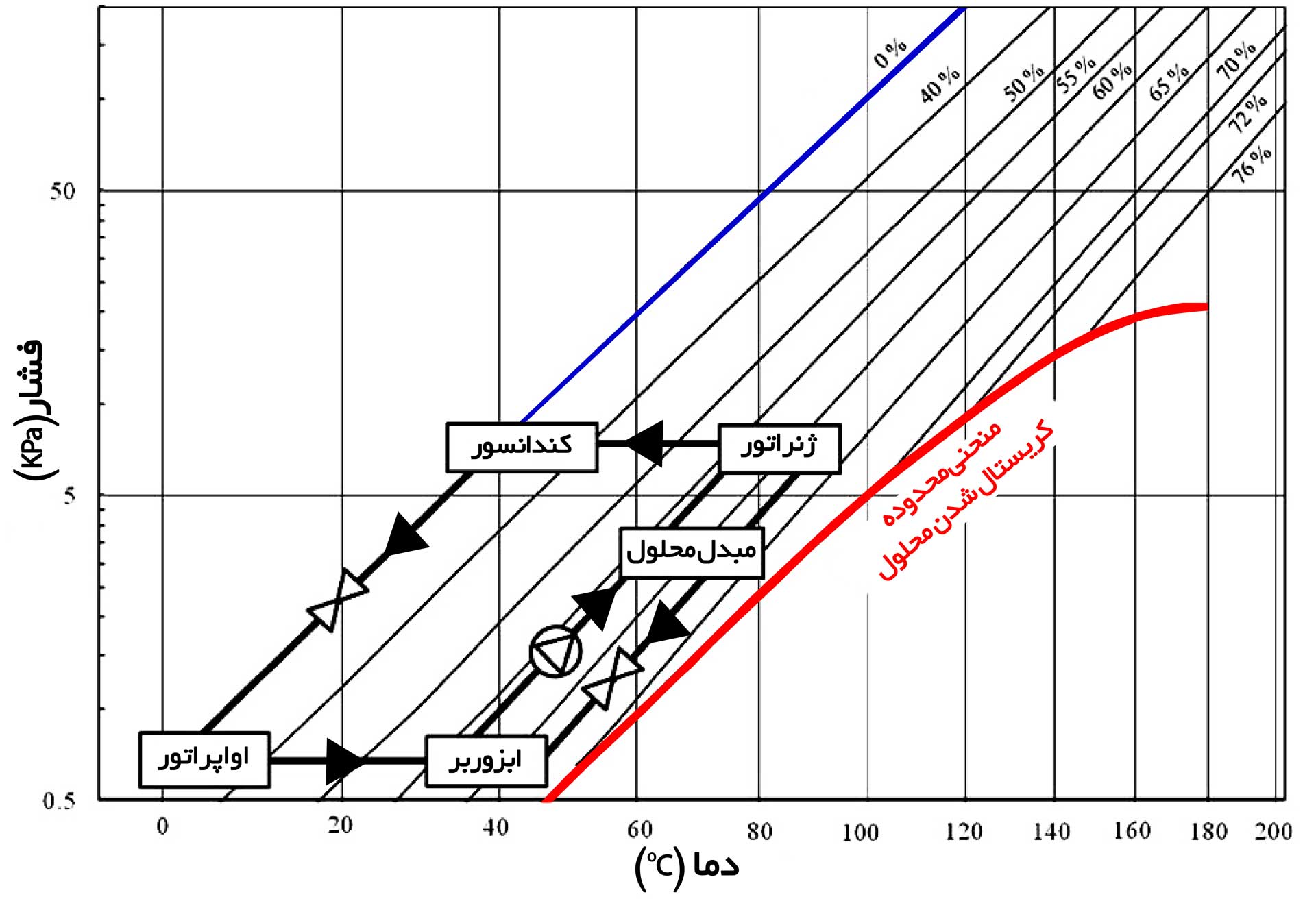
شکل – ۴، نمایش غلظت و دمای محلول و دمای مبرد در نقاط مختلف سیکل چیلر جذبی روی نمودار دورینگ
همانطور که در شکل ۴ قابل مشاهده است، خط محلول غلیظ از ژنراتور به ابزوربر، به منحنی قرمز رنگ ناحیه کریستال نزدیک تر بوده و به نوعی این خط بحرانی ترین قسمت در سیکل چیلر جذبی است که در صورت خارج شدن چیلر از شرایط استاندارد، ممکن است پدیده کریستال رخ دهد.
منابع
Christoph, K. Flue gas fired absorption chillers. PHYSIK-DEPARTMENT, TECHNISCHE UNIVERSITÄT MÜNCHEN. Dissertation.
Wang, Xiaolin & Chua, Hui. (2010). Absorption Cooling: A Review of Lithium Bromide-Water Chiller Technologies.